W branżach farmaceutycznej, kosmetycznej i weterynaryjnej, czystość mikrobiologiczna produktów niejałowych stanowi jeden z krytycznych parametrów jakościowych. Choć produkty te nie muszą być jałowe, obowiązujące przepisy prawa oraz zasady Dobrej Praktyki Wytwarzania (GMP) jasno określają, jakie wymagania mikrobiologiczne muszą spełniać, aby mogły zostać uznane za bezpieczne i dopuszczone do obrotu. Niedostosowanie się do tych wymogów nie tylko naraża producenta na sankcje prawne i wycofania produktów, ale także na utratę zaufania klientów oraz partnerów biznesowych.
Podstawy prawne i wymagania farmakopealne
Głównym źródłem wytycznych dotyczących czystości mikrobiologicznej produktów niejałowych w Europie jest Farmakopea Europejska (Ph. Eur.), której zapisy są obowiązujące we wszystkich krajach członkowskich UE. Wydanie 11.0 Ph. Eur. zawiera dwa kluczowe rozdziały dotyczące tej tematyki:
- Rozdział 2.6.12 – Microbiological Examination of Non-Sterile Products: Total Aerobic Microbial Count – definiuje metody oznaczania całkowitej liczby drobnoustrojów tlenowych (bakterii i grzybów).
- Rozdział 2.6.13 – Microbiological Examination of Non-Sterile Products: Test for Specified Microorganisms – opisuje badania w kierunku mikroorganizmów specyficznych, których obecność jest niedopuszczalna w zależności od kategorii produktu – np. Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Salmonella spp., Candida albicans.
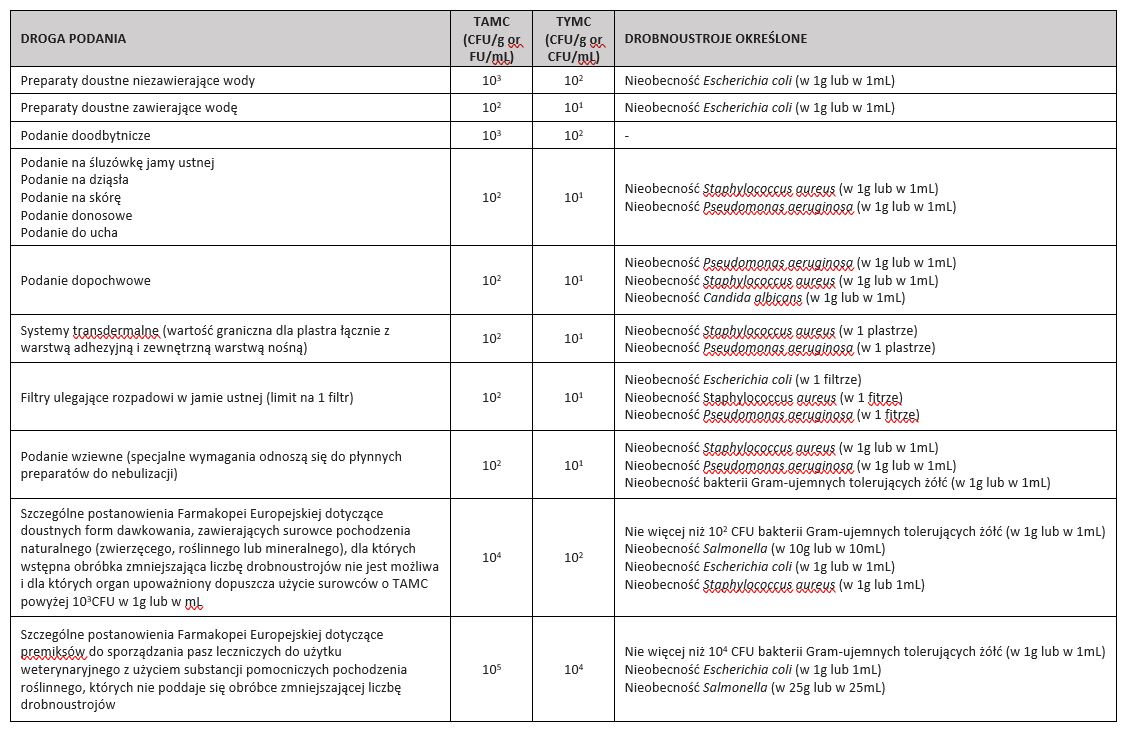
Wymagania ilościowe są z kolei określone w tabeli z rozdziału 5.1.4. „Microbiological quality of non-sterile pharmaceutical preparations and substances for pharmaceutical use”, która podaje dopuszczalne limity CFU/g (lub CFU/ml) dla różnych kategorii produktów:
Poza drobnoustrojami wymienionymi w tabeli, oceniane jest znaczenie innych drobnoustrojów
w zależności od:
– użycia produktu: ryzyko różni się zależnie od drogi podania (oko, nos, drogi oddechowe)
– właściwości produktu: jego zdolność do podtrzymywania wzrostu, obecność właściwej ochrony przeciwdrobnoustrojowej
– sposobu podania
– docelowej grupy pacjentów: ryzyko może być różne dla noworodków, niemowląt, osób osłabionych
– stosowania czynników immunosupresyjnych, kortykosteroidów
– występowania chorób, ran, uszkodzeń narządów
W przypadku surowców ocena uwzględnia proces, któremu produkt jest poddany, aktualną technikę badania i dostępność materiałów o pożądanej jakości.
Wymogi GMP i odpowiedzialność producenta
Zgodnie z zasadami GMP, a w szczególności Aneksu 1 i 15, kontrola mikrobiologiczna produktów niejałowych jest obowiązkowa na etapie zwalniania serii. Wytwórca ma obowiązek nie tylko przeprowadzać badania, ale również wykazać, że metody stosowane do oznaczeń są odpowiednie, poprzez przeprowadzanie przydatności metod badania względem badanej matrycy. Wymaganie to zapisano zarówno w Farmakopei, jak i Rozporządzeniu GMP.
Co istotne, GMP kładzie duży nacisk na kompleksowe zarządzanie jakością mikrobiologiczną, które obejmuje:
- kwalifikację i monitoring wody stosowanej w produkcji (woda oczyszczona, woda do iniekcji),
- kontrolę czystości mikrobiologicznej powietrza, powierzchni i personelu (jeśli wymagane),
- badanie surowców i opakowań,
- walidację procesów czyszczenia i dezynfekcji,
- walidację procesów wytwarzania
- kontrolę końcową produktu gotowego na zgodność z zarejestrowanymi specyfikacjami
Wszystkie powyższe aspekty są kontrolowane przez Główny Inspektorat Farmaceutyczny (GIF) podczas inspekcji. Nieprawidłowości z nimi wiązane są źródłem uwag i niezgodności, wobec których Wytwórcy farmaceutyczni muszą wdrażać działania korygujące i zapobiegawcze.
Dlaczego warto zlecać badania mikrobiologiczne do naszego laboratorium?
Nasze laboratorium posiada zezwolenie GMP w zakresie Kontroli Jakości – analizy mikrobiologiczne – wydane przez Główny Inspektorat Farmaceutyczny. Dodatkowo posiadamy doświadczenie badawcze w mikrobiologii farmaceutycznej. Oferujemy pełne wsparcie w zakresie oceny czystości mikrobiologicznej produktów niejałowych, od pojedynczych analiz po kompleksową kontrolę serii, walidację metod, przygotowanie dokumentacji do inspekcji i audytów GMP oraz monitoring mikrobiologiczny środowiska wytwarzania.
Dysponujemy wykwalifikowanym zespołem mikrobiologów z wieloletnim doświadczeniem w pracy w laboratoriach kontroli jakości. Pracujemy zgodnie z aktualnymi wymaganiami Farmakopei, ISO oraz GMP, a nasze laboratoria są przystosowane do pracy z produktami wymagającymi szczególnego nadzoru. Rozumiemy, że dla naszych klientów kluczowa jest nie tylko precyzja badań, ale również szybkość ich realizacji, elastyczność i merytoryczne wsparcie. Czystość mikrobiologiczna produktów niejałowych to obszar, który nie toleruje kompromisów. Zarówno z punktu widzenia przepisów prawa, jak i odpowiedzialności wobec pacjentów i konsumentów, jej kontrola powinna być priorytetem każdego producenta. Dobrze przeprowadzona analiza mikrobiologiczna to nie tylko wynik na raporcie, to dowód, że produkt spełnia najwyższe standardy jakości.
Kontakt w sprawie oferty:
K: +48 517 917 834
E: sales@jci.pl